
Sadržaj:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
X = [Fe(SCN)2+] i treba ga odrediti iz standardne krive. Tada možete izračunati konstanta ravnoteže , Keq , koristeći ravnoteža koncentracije. Standardna kriva je dijagram od Upijanje u odnosu na [Fe(SCN)2+] (Slika 8.1). Može se koristiti da nam da koncentraciju otopine kada se dobije apsorbancija.
Imajući ovo u vidu, kako pronalazite ravnotežnu koncentraciju iz apsorbancije?
Dakle, [Fe(SCN)2+]ekv može se odrediti direktno iz apsorbancija mjerenja. Ravnotežne koncentracije reaktanata može se izračunati oduzimanjem ravnotežna koncentracija proizvoda od početnog koncentracije reaktanata.
Drugo, šta je FeSCN? The FeSCN 2+ Kompleks koji nastaje kao rezultat reakcije između gvožđa(III) i tiocijanatnih jona ima veoma intenzivnu krvavo crvenu boju (ili narandžastu u razblaženom rastvoru), što omogućava laku detekciju i kvantitativno određivanje spektrofotometrijom. Reaktanti (Fe3+ i SCN-) su praktično bezbojni.
Na ovaj način, kako ćete pronaći ravnotežnu koncentraciju iz Beerovog zakona?
ravnotežna koncentracija proizvoda
- [FeSCN2+] u ravnoteži se određuje korišćenjem Beerovog zakona; x je količina FeSCN2+ stvoreno (utvrđeno eksperimentalno).
- x = [FeSCN 2+] ekv =
- a.
- Koristite Eq.
- Pronađite prosječnu vrijednost Kekv, standardnu devijaciju i relativnu grešku (standardna devijacija podijeljena prosjekom).
Šta znači KEQ?
Keq samo vam govori šta će biti favorizovano u ravnoteži. Pošto Keq = [proizvodi]/[reaktanti] velika vrijednost k (k>>1) znači da će reakcija favorizirati proizvode mnogo više, što znači da ćete kada reakcija postigne ravnotežu imati uglavnom proizvode.
Preporučuje se:
Kako se izračunava sila ravnoteže?

Neto sila mora biti nula Neto sila koja djeluje na objekt mora biti nula. Stoga sve sile balansiraju u svakom smjeru. Na primjer, automobil koji se kreće duž autoputa konstantnom brzinom je u ravnoteži, jer ne ubrzava ni u jednom naprijed ni u vertikalnom smjeru. Matematički, ovo je navedeno kao Fnet = ma = 0
Kako pronaći konstantu proporcionalnosti u grafu?
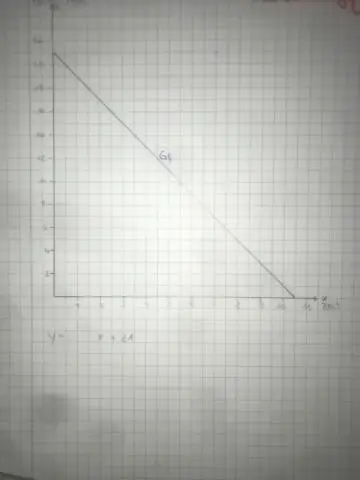
Da biste pronašli svoju konstantu proporcionalnosti iz grafa, slijedite ove korake: Pronađite dvije jednostavne točke. Počnite s krajnjom lijevom tačkom i prebrojite koliko kvadrata trebate gore da biste došli do svoje druge točke. Izbroj koliko kvadrata treba da ideš udesno. Pojednostavite i našli ste svoju konstantu proporcionalnosti
Kako se određuju konstante ravnoteže?

Numerička vrijednost konstante ravnoteže dobiva se tako što se jedna reakcija nastavi do ravnoteže, a zatim se mjere koncentracije svake supstance uključene u tu reakciju. Izračunava se omjer koncentracija proizvoda i koncentracija reaktanata
Kako pronalazite koncentraciju DNK iz apsorbancije?

Koncentracija DNK se procjenjuje mjerenjem apsorbancije na 260 nm, prilagođavanjem mjerenja A260 za zamućenost (mjereno apsorbancijom na 320 nm), množenjem faktorom razrjeđenja i korištenjem odnosa da je A260 od 1,0 = 50 µg/ml čiste dsDNA
Što se podrazumijeva pod konstantom ravnoteže i kako se ona eksperimentalno određuje?

Iz Wikipedije, slobodne enciklopedije. Konstante ravnoteže se određuju kako bi se kvantificirale kemijske ravnoteže. Kada je konstanta ravnoteže K izražena kao kvocijent koncentracije, podrazumijeva se da je kvocijent aktivnosti konstantan
