
Sadržaj:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
U oksidacioni broj metod, vi određujete oksidacioni brojevi svih atoma. Zatim množite atome koji su se promijenili sa malom cjelinom brojevi . Ukupan gubitak elektrona činite jednakim ukupnom dobitku elektrona. Onda ti balans ostatak atoma.
U skladu s tim, kako uravnotežiti jednačine redukcije oksidacije?
Slijedite ova pravila kako biste uravnotežili jednostavne redoks jednadžbe:
- Napišite polu-reakcije oksidacije i redukcije za vrstu koja je reducirana ili oksidirana.
- Pomnožite polureakcije odgovarajućim brojem tako da imaju jednak broj elektrona.
- Dodajte dvije jednačine da poništite elektrone.
Drugo, kako balansirate jednačine? Metoda 1 Uspostavljanje tradicionalne ravnoteže
- Zapišite datu jednačinu.
- Zapišite broj atoma po elementu.
- Sačuvajte vodonik i kiseonik za kraj, jer su često na obe strane.
- Počnite s pojedinačnim elementima.
- Koristite koeficijent za balansiranje jednog atoma ugljika.
- Zatim izbalansirajte atome vodika.
- Uravnotežite atome kiseonika.
Takođe, kako lako izbalansirati hemijske jednačine?
Općenito, da bismo uravnotežili jednačinu, evo stvari koje trebamo učiniti:
- Izbrojite atome svakog elementa u reaktantima i produktima.
- Koristite koeficijente; stavite ih ispred jedinjenja po potrebi.
Da li je C o2 co2 redoks reakcija?
Da li je C + O2 = CO2 intramolekularno redoks reakcija ili ne? Jedan reaktant (ugljik) se oksidira, a drugi (kiseonik) redukuje. Dakle, ovo je jednostavna intermolekularna redoks reakcija . Bilo koji reakcija u kojima su jedan ili više reaktanata/proizvoda čisti elementi moraju biti a redoks reakcija.
Preporučuje se:
Kako izvodite operacije s cijelim brojevima?

Cijeli brojevi su cijeli brojevi, pozitivni i negativni. Na njima možete izvesti četiri osnovne matematičke operacije: sabiranje, oduzimanje, množenje i dijeljenje. Kada dodajete cijele brojeve, zapamtite da vas pozitivni cijeli brojevi pomiču udesno na brojevnoj pravoj, a negativni cijeli brojevi vas pomiču lijevo na brojevnoj pravoj
Kako izvodite eksponente s negativnim brojevima?

Ako se negativan broj podigne na neparan stepen, rezultat će biti negativan. Negativan broj mora biti ograđen zagradama da bi se eksponent primijenio na negativni član. Eksponenti se pišu kao superskriptni broj (npr. 34) ili im prethodi znak (^) simbol (npr. 3^4)
Kako koristite formule u brojevima?

Umetanje formule Kliknite na ćeliju u kojoj želite da se pojavi rezultat, a zatim unesite znak jednakosti (=). Kliknite na ćeliju koju želite koristiti u formuli ili upišite vrijednost (na primjer, broj kao što je 0 ili 5,20). Upišite aritmetički operator (na primjer, +, -, * ili /), a zatim odaberite drugu ćeliju koju ćete koristiti u formuli ili upišite vrijednost
Kako je konfiguracija elektrona povezana s kvantnim brojevima?
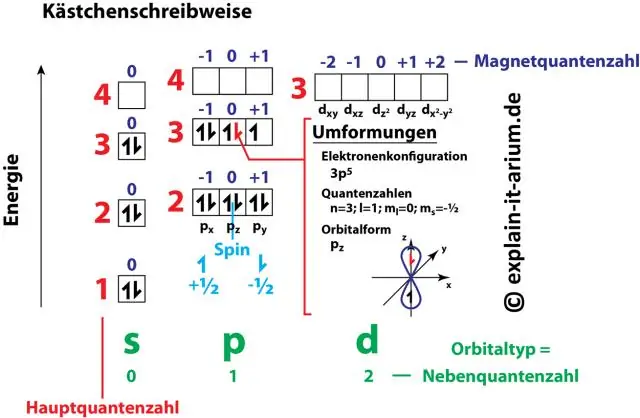
Parovi brojeva i slova u elektronskoj konfiguraciji predstavljaju dva od četiri elektronska kvantna broja. Ovi kvantni brojevi nam govore više o svojstvima elektrona i njihovih orbitala. Glavni kvantni broj (n) nam govori o energetskom nivou elektrona i njegovoj veličini
Prilikom balansiranja hemijske jednadžbe možete samo promijeniti?

Kada uravnotežite jednadžbu, možete promijeniti samo koeficijente (brojeve ispred molekula ili atoma). Koeficijenti su brojevi ispred molekula. Subscripts su manji brojevi koji se nalaze nakon atoma. One se ne mogu mijenjati prilikom balansiranja hemijskih jednačina
