
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
Avogadrov zakon kaže da je zapremina gasa direktno proporcionalna broju molova gasa. Dok raznesete košarkašku loptu, tjerate više molekula plina u nju. Što je više molekula, to je veća zapremina. Košarkaška lopta se naduvava.
Osim toga, zašto je važan Avogadrov zakon?
Avogadrov zakon istražuje odnos između količine gasa (n) i zapremine (v). To je direktna veza, što znači da je zapremina gasa direktno proporcionalna broju molova u uzorku gasa. The zakon je bitan jer nam dugoročno pomaže da uštedimo vrijeme i novac.
Osim gore navedenog, kakav odnos opisuje Avogadrov zakon? Amedo Avogadro pronašao odnos između zapremine gasa i broja molekula sadržanih u zapremini. The zakon navodi da "jednaki volumen svih plinova na istoj temperaturi i pritisku sadrži isti broj molekula ili molova".
Imajući ovo u vidu, kako dokazati Avogadrov zakon?
Avogadrov zakon je u dokazu kad god nanesete balon. Volumen balona se povećava kako dodajete molove gasa u balon tako što ćete ga naduvati. Ako je spremnik koji drži plin krut, a ne fleksibilan, volumen se može zamijeniti pritiskom Avogadrov zakon.
Koja je jedinica Avogadrova broja?
Avogadrov broj , broj of jedinice u jednom molu bilo koje supstance (definisano kao njena molekulska težina u gramima), jednako 6,02214076 × 1023. The jedinice mogu biti elektroni, atomi, ioni ili molekuli, ovisno o prirodi tvari i karakteru reakcije (ako postoji).
Preporučuje se:
Kako se zakon inercije koristi u svakodnevnom životu?
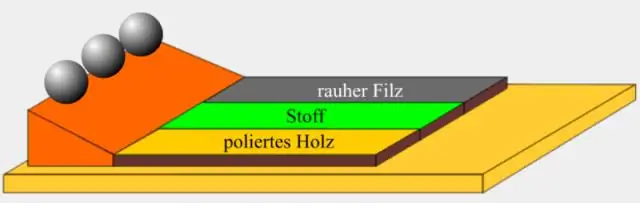
Pokret tijela u stranu kada automobil napravi oštar zaokret. Zatezanje sigurnosnih pojaseva u automobilu kada se brzo zaustavi. Lopta koja se kotrlja niz brdo nastavit će se kotrljati osim ako je trenje ili druga sila ne zaustave. Inercija to uzrokuje tako što objekt želi nastaviti kretanje u smjeru u kojem je bio
Kako rješavate Avogadrov zakon?

Pri konstantnom pritisku i temperaturi Avogadrov zakon se može izraziti sljedećom formulom: V ∝ n. V/n = k. V1/n1 = V2/n2 (= k, prema Avogadrovom zakonu). PV = nRT. V/n = (RT)/P. V/n = k. k = (RT)/P. Jedan mol gasa helijuma napuni prazan balon do zapremine od 1,5 litara
Kako demonstrirate Avogadrov zakon?

Avogadrov zakon je na snazi kad god raznesete balon. Volumen balona se povećava kako dodajete molove gasa u balon tako što ćete ga naduvati. Ako je spremnik koji drži plin krut, a ne fleksibilan, tlak se može zamijeniti zapreminom u Avogadrovom zakonu
Kako pronaći volumen koristeći Avogadrov zakon?

Avogadrov zakon pokazuje da postoji direktna veza između broja molova gasa i njegove zapremine. Ovo se takođe može prikazati pomoću jednačine: V1/n1 = V2/n2. Ako se broj molova udvostruči, volumen će se udvostručiti
Kako se koristi drugi Newtonov zakon?

U zaključku, drugi Newtonov zakon daje objašnjenje za ponašanje objekata na kojima sile nisu u ravnoteži. Zakon kaže da neuravnotežene sile uzrokuju ubrzanje objekata ubrzanjem koje je direktno proporcionalno neto sili i obrnuto proporcionalno masi
