
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-06-01 05:03.
The standardna entalpija reakcije (ΔHorxn) može biti izračunati od zbira standardne entalpije formiranja proizvoda (svaki pomnožen sa svojim stehiometrijskim koeficijentom) minus zbir od standardne entalpije formiranja reaktanata (svaki pomnožen sa svojim stehiometrijskim koeficijentom) - „proizvodi
Isto tako, koja je standardna entalpija sagorijevanja?
Standardna entalpija sagorevanja se definiše kao entalpija promjena kada jedan mol spoja potpuno izgori u kisiku sa svim reaktantima i produktima u njima standard stanje pod standard uslovima (298K i pritisak 1 bar).
Znajte i koje su jedinice entalpije? The SI jedinica za specifičnu entalpiju je džul po kilogramu. Može se izraziti u drugim specifičnim veličinama sa h = u + pv, gde je u specifična unutrašnja energija, p je pritisak, a v specifična zapremina, koja je jednaka 1ρ, gde je ρ gustina.
Neko se takođe može zapitati, kako definišete entalpiju?
Entalpija je termodinamičko svojstvo sistema. To je zbir unutrašnje energije dodane proizvodu pritiska i zapremine sistema. Odražava sposobnost obavljanja nemehaničkog rada i sposobnost oslobađanja topline. Entalpija označava se kao H; specifično entalpija označeno kao h.
Kolika je entalpija h2o?
entalpija formiranja za H2O (l)(-285,8kJ/mol) je manji od onog za H2O (g)(-241,82 kJ/mol).
Preporučuje se:
Kako pronalazite standardnu devijaciju i srednju vrijednost u Excelu?
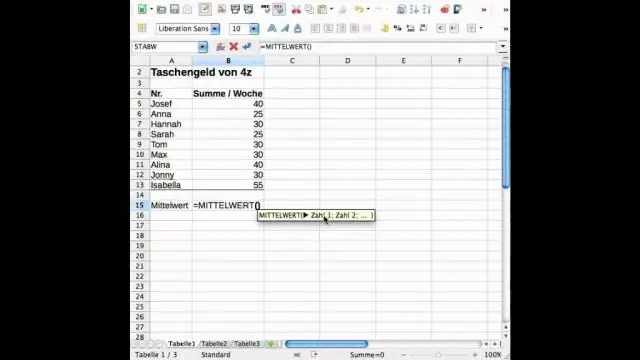
Standardna devijacija je mjera koliko varijanse postoji u skupu brojeva u poređenju sa prosjekom (sredinom) brojeva. Da biste izračunali standardnu devijaciju u Excelu, možete koristiti jednu od dvije primarne funkcije, ovisno o skupu podataka. Ako podaci predstavljaju cijelu populaciju, možete koristiti STDEV. Pfunction
Kako dolazi do nepotpunog sagorijevanja?

Nepotpuno sagorijevanje nastaje kada je dotok zraka ili kisika loš. Voda se i dalje proizvodi, ali se umjesto ugljičnog dioksida proizvode ugljični monoksid i ugljik. Ugljik se oslobađa kao čađ. Ugljični monoksid je otrovan plin, što je jedan od razloga zašto se preferira potpuno sagorijevanje nego nepotpuno
Kako pronalazite standardnu devijaciju od varijabilnosti?

Da biste izračunali standardnu devijaciju, zbrojite sve tačke podataka i podijelite ih s brojem podataka, izračunajte varijansu za svaku tačku podataka i zatim pronađite kvadratni korijen varijanse
Kako uravnotežiti jednačinu sagorijevanja?

Balansiranje reakcija sagorevanja je jednostavno. Prvo, uravnotežite atome ugljika i vodika na obje strane jednačine. Zatim izbalansirajte atome kiseonika. Konačno, uravnotežite sve što je postalo neuravnoteženo
Kako pronalazite standardnu poziciju?

Standardni položaj ugla - trigonometrija Jedna strana ugla je uvek fiksirana duž pozitivne x-ose - odnosno ide udesno duž ose u pravcu 3 sata (linija BC). To se zove početna strana ugla. Druga strana ugla naziva se krajnja strana
