
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
Kao primjer obveznica entalpija disocijacije, to break 1 mol molekula plinovitog klorovodika u odvojene atome plinovitog vodika i klora uzima 432 kJ. The obveznica entalpija disocijacije za H-Cl obveznica je +432 kJ mol-1.
| obveznica entalpija (kJ mol-1) | |
|---|---|
| C-Cl | +346 |
| H-Cl | +432 |
Nakon toga, neko se takođe može pitati, kako izračunati energiju potrebnu za prekid veze?
Energija veze je definisan zbirom svih obveznice slomljeno minus zbir svih obveznice formirano: ΔH = ∑H( obveznice slomljena) - ∑H( obveznice formirana). ΔH je promjena u energija veze , koji se takođe naziva obveznica entalpija i ∑H je zbir obveznica energije za svaku stranu jednačina.
Neko se takođe može zapitati, zašto je potrebna energija da se raskine veza? Energija je potrebno to raskinuti veze . Atomi su mnogo sretniji kada su "vjenčani" i oslobođeni energije jer je lakše i stabilnije biti u vezi (npr. generirati oktetne elektronske konfiguracije). Promjena entalpije je negativna jer se sistem otpušta energije prilikom formiranja obveznica.
Štaviše, koliko je energije potrebno da se razbije vodonična veza?
U vodi vodonične veze , the vodonik atom je kovalentno vezan za kiseonik molekule vode (492,2145 kJ ˣ mol-1 [350]), ali ima (optimalno) dodatnu privlačnost (oko 23,3 kJ mol-1 [168]. Ovo je energije (ΔH) potrebno za razbijanje the obveznica i potpuno razdvajanje atoma.
Da li prekid veze oslobađa energiju?
Breaking i pravljenje Energija veza se apsorbuje u raskinuti veze . Bond - razbijanje je endotermni proces. Energija je pušten kada je nova obveznice formu. Da li je reakcija endotermna ili egzotermna zavisi od razlike između energije potrebno za raskinuti veze i oslobođena energija kada je nova obveznice formu.
Preporučuje se:
Koja je razlika između energije veze i energije disocijacije veze?

Glavna razlika između energije veze i energije disocijacije veze je u tome što je energija veze prosječna količina energije potrebna za razbijanje svih veza između iste dvije vrste atoma u spoju, dok je energija disocijacije veze količina energije potrebna za razbijanje određene nehomolize veze
Kako vodikova veza između molekula vode može pomoći u objašnjavanju sposobnosti vode da apsorbira velike količine energije prije isparavanja?
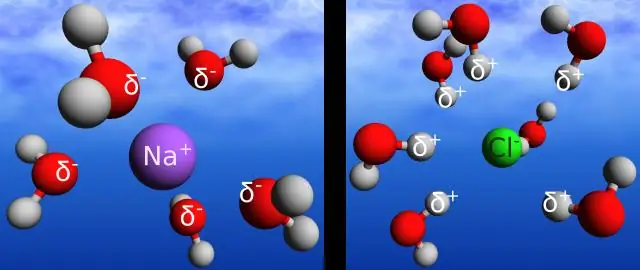
Vodikove veze u vodi omogućavaju joj da apsorbira i oslobađa toplinsku energiju sporije od mnogih drugih tvari. Temperatura je mjera kretanja (kinetičke energije) molekula. Kako se kretanje povećava, energija je veća, a samim tim i temperatura
Da li je vodonična veza ista kao i kovalentna veza?
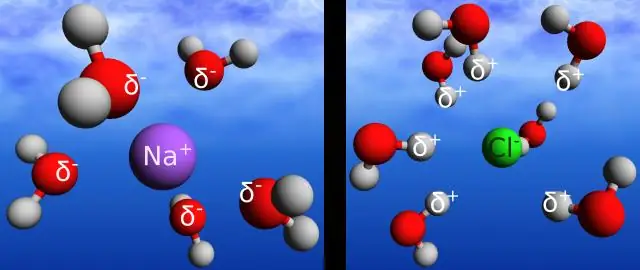
Vodikova veza je naziv za elektrostatičku interakciju između pozitivnog naboja na atomu vodika i negativnog naboja na atomu kisika susjedne molekule. Kovalentna veza je elektrostatička interakcija između dva atoma u istoj molekuli
Koji su neki primjeri između električne energije i mehaničke energije?

Primjeri uređaja koji pretvaraju električnu energiju u mehaničku energiju - drugim riječima, uređaji koji koriste električnu energiju za pomicanje nečega - uključuju: motor u današnjim standardnim bušilicama. motor u današnjim standardnim motornim testerama. motor u električnoj četkici za zube. motor električnog automobila
Koja je razlika između očuvanja energije i principa očuvanja energije?

Kalorijska teorija je tvrdila da se toplota ne može ni stvoriti ni uništiti, dok očuvanje energije podrazumeva suprotan princip da su toplota i mehanički rad međusobno zamenljivi
