
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
Pronađite ograničavajući reagens gledajući broj molova svakog od njih reaktant . Odredite uravnoteženu hemikaliju jednačina za hemijsku reakciju. Pretvorite sve date informacije u molove (najvjerovatnije, korištenjem molarne mase kao faktora konverzije). Izračunajte molski omjer iz datih informacija.
Prema tome, koji je granični reaktant u jednačini?
Ograničavajući reaktant - The reaktant u hemijskoj reakciji koja ograničava količinu proizvoda koji se može formirati. Reakcija će prestati kada sve limitingreactant se konzumira. Višak reaktanta - The reaktant u hemijskoj reakciji koja ostaje kada reakcija prestane kada se ograničavajući reaktant je u potpunosti potrošen.
Slično tome, koji je ograničavajući reaktant u vodi? Kiseonik (O2) proizvodi manje vode (H2O) nego vodonik (H2) dakle kisik je ograničavajući reaktant.
Ovdje, šta je ograničavajući reagens objasniti?
The ograničavajući reagens (ili ograničavajući reaktant ili ograničavajući agens) u hemijskoj reakciji je supstanca koja se u potpunosti troši kada se hemijska reakcija završi. Količina nastalog proizvoda je ograničena ovim reagens , jer se reakcija ne može nastaviti bez toga.
Kako pronaći molove proizvoda ograničavajućeg reaktanta?
Ako vam se da madeži prezent svake reaktant , i zamolio da naći the limitingreactant određene reakcije, tada najjednostavniji način naći koji je ograničavajući je podijeliti svaku vrijednost sa odgovarajućim koeficijentom te supstance u (uravnoteženoj) hemijskoj jednačini; koja god vrijednost je najmanja je limitingreactant.
Preporučuje se:
Šta znači ograničavajući faktor ovisan o gustoći?
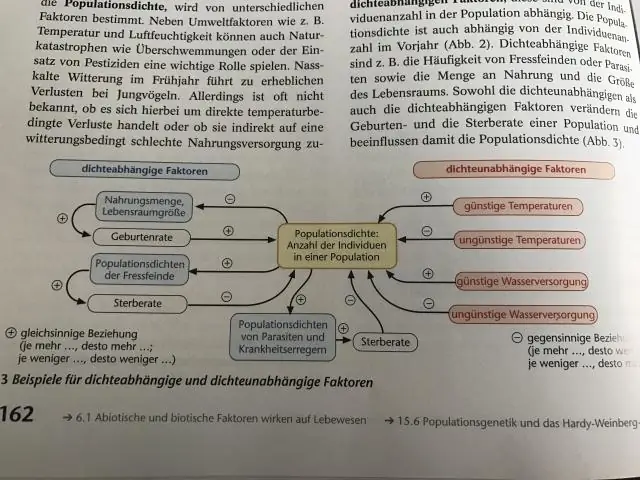
Ograničavajući faktori zavisni od gustine Faktori zavisni od gustine su faktori čiji efekti na veličinu ili rast populacije variraju sa gustinom naseljenosti. Postoje mnoge vrste ograničavajućih faktora zavisnih od gustine kao što su; dostupnost hrane, grabež, bolesti i migracije
Zašto je Daltonov zakon ograničavajući zakon?

Ograničenje Daltonovog zakona Zakon važi za stvarne gasove pri niskom pritisku, ali pri visokom pritisku značajno odstupa. Smjesa plinova je po prirodi nereaktivna. Također se pretpostavlja da je interakcija između molekula svakog pojedinačnog plina ista kao i molekula u smjesi
Šta znači ograničavajući faktor?

Definicija ograničavajućeg faktora. 1: faktor koji ograničava brzinu reakcije u bilo kojem fiziološkom procesu kojim upravljaju mnoge varijable. 2: okolišni faktor koji je od dominantne važnosti u ograničavanju veličine populacije nedostatak zimskog pregleda je ograničavajući faktor za mnoga stada jelena
Da li je hrana ograničavajući faktor?

Neki primjeri ograničavajućih faktora su biotički, poput hrane, parova i nadmetanja s drugim organizmima za resurse. Na primjer, ako u šumi nema dovoljno životinja plijena za prehranu velike populacije grabežljivaca, tada hrana postaje ograničavajući faktor
Zašto je intenzitet svjetlosti ograničavajući faktor u fotosintezi?

Intenzitet svjetlosti Bez dovoljno svjetla, biljka ne može vrlo brzo fotosintetizirati - čak i ako ima puno vode i ugljičnog dioksida i odgovarajuću temperaturu. Povećanje intenziteta svetlosti povećava brzinu fotosinteze, sve dok neki drugi faktor – ograničavajući faktor – ne postane nedostatak
