
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Zadnja izmjena 2025-01-22 16:56.
The volumen od date količine gas je obrnuto proporcionalna njegov pritisak kada temperatura drži se konstantnim (Boyleov zakon). Pod istim uslovima od temperatura i pritisak , jednako tomovi od svega gasovi sadrže isti broj molekula (Avogadrov zakon).
Onda, kako je zapremina gasa povezana sa njegovom temperaturom?
The zapreminu gasa je direktno proporcionalna its apsolutno temperatura . Tačnije, za fiksnu masu od gas pri konstantnom pritisku, tj volumen (V) je direktno proporcionalna apsolutu temperatura (T). Ovo je Charlesov zakon. The volumen je direktno u apsolut temperatura.
Osim gore navedenog, kakav je odnos između temperature i pritiska? Kao što je temperatura Ako se poveća, molekuli u plinu se kreću brže, češće udaraju u spremnik plina i vrše veću silu. Ovo povećava pritisak . I slično kao pritisak ide gore, the temperatura takođe ide gore. Dakle temperatura i pritisak direktno proporcionalne jedna drugoj.
Od toga, kakav je uticaj pritiska na zapreminu gasa?
Odnos između Pritisak i Volume : Boyle's Law As the pritisak na gas povećava, volumen of the gas smanjuje jer gas čestice se približavaju jedna drugoj. Obrnuto, kao pritisak na gas smanjuje, zapremina gasa povećava jer gas čestice se sada mogu dalje udaljavati.
Da li pritisak raste sa temperaturom?
Gay-Lussacov zakon je jedan dio zakona o idealnom plinu i tako objašnjava kako se gasovi promijeniti kada se volumen održava konstantnim. Kao što je temperatura raste , molekuli u plinu se kreću brže, češće udarajući u spremnik plina i vršeći veću silu. Ovo povećava the pritisak.
Preporučuje se:
Kako se izračunava zapremina deplasmana u farmaciji?

Zapreminski volumen lijeka X je 0,5mL/40mg. Ako je potrebna koncentracija 4mg u 1mL, tada je potrebno 20mL za 80mg lijeka X. Ako 40mg istiskuje 0,5mL otopine, to znači da 80mg istiskuje 1mL. 20mL – 1mL = 19mL potrebnog razblaživača
Kako je struktura hloroplasta povezana s njegovom funkcijom?
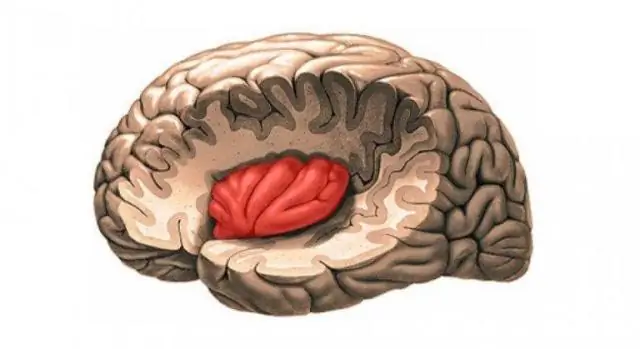
Hloroplast. Struktura hloroplasta je prilagođena funkciji koju obavlja: Tilakoidi – spljošteni diskovi imaju mali unutrašnji volumen kako bi se maksimizirao gradijent vodonika nakon akumulacije protona. Fotosistemi – pigmenti organizirani u fotosisteme u tilakoidnoj membrani kako bi se maksimizirala apsorpcija svjetlosti
Kako se dijamanti prave pod pritiskom?

Dijamanti su napravljeni od ugljika pa se formiraju kao atomi ugljika pod visokom temperaturom i pritiskom; oni se vežu kako bi počeli rasti kristale
Kako se provodljivost poluvodiča mijenja s temperaturom?

Kada povećate temperaturu ovih poluvodiča, elektroni će dobiti više energije, tako da se sami izvuku iz veze i tako postaju slobodni. Što više povećavate temperaturu, više će se elektronika osloboditi, a samim tim i provodljivost se povećava
KAKO JE boja zvijezde povezana s temperaturom?

Zvijezde s površinskom temperaturom do 3500°C su crvene. Obojiti vertikalni stup od 2.000°C do 3.500°C svijetlocrvenom bojom. Obojite kolone ostalih boja na sljedeći način: Zvijezde do 5000°C su narandžasto-crvene; do 6.000°C žuto-bijelo; do 7.500°C plavo-bijela i do 40.000°C plava
